Kimyasal Bağ Nedir
Atomları bir arada tutan kuvvete kimyasal bağ denir.
Atomlar kimyasal bağlar ile bileşikler oluşturur.
Kimyasal bağ olmasaydı farklı türde maddeler meydana gelmeyecekti.
Kimyasal bağ elektronlarla oluşur.
İki çeşit kimyasal bağ vardır. İyonik ve kovalent bağ (8. Sınıf konusuna göre)
1. İyonik Bağ
Metal ve ametal atomları arasında elektron alış verişi ile gerçekleşen bağa iyonik bağ denir.
Metallerin son yörüngelerinde 1, 2, 3 elektron bulunur.
Ametallerin ise son yörüngelerinde 5, 6, 7 elektron bulunur.
Metaller fazlalık elektronlarını ametallere vererek her ikisi de kararlı yapıya ulaşırlar.
Metaller katyon (+), ametaller (-) yüklü oldukları için aralarında elektriksel çekim kuvveti oluşur. Sofra tuzu (NaCl) iyonik yapılı bileşiktir.
İyonik bağın özellikleri
- Metal ve ametal atomları arasında iyonik bağ oluşur.
- Metal atomu ametal atomuna elektron verir.
- Metal atomu katyon (+), ametal atomu da anyon (-) olur.
- İyonik bağlı bileşikler kristal yapıdadır.
- Bileşikleri sert ve kırılgandır.
- Katı halde elektrik akımını iletmezler, sulu çözeltileri elektrik akımını iletir.
2. Kovalent Bağ
Ametal atomları arasında elektronların ortaklaşa kullanılması ile oluşan kimyasal bağdır.
Ametal atomlarının son yörüngelerinde dublet ve oktet kuralına uyacak kadar elektron bulunmaz. Bu nedenle ametal atomları elektronlarını ortaklaşa kullanırlar. Elektronlar ortaklaşa kullanıldığı için aralarında kimyasal bağ meydana gelir. CO, CO2 , O2 , H2 , H2O kovalent bağlı bileşiklerdir.
Kovalent bağın özellikleri
- Elektronlar ortaklaşa kullanılır.
- Ametal atomları arasında oluşur.
- Kovalent bağ aynı veya farklı cins ametal atomları arasında oluşabilir.
- Kovalent bağlı bileşikler molekül yapılıdır.
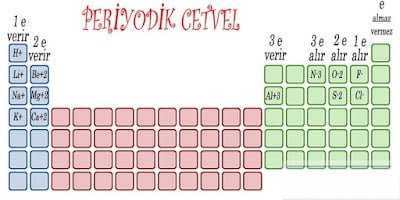 |
| Periyodik Sistemde İyon Yükleri |
Kararsız yapıdaki atomların kararlı yapıya ulaşmak için, elektron alması veya elektron vermesi gerekmektedir.
Elektron alan atom negatif yüklü iyonu (Anyon), elektron veren atom pozitif yüklü atom (Katyon) oluşturur.
Periyodik cetvel incelendiğinde aynı grupta yer alan element atomlarının son yörüngelerinde aynı sayıda elektron bulunduğu görülür. 2A grubu elementleri incelendiğinde Berilyum (Be), Magnezyum (Mg) ve Kalsiyum (Ca) elementlerinin son yörüngelerinde iki elektron olduğu görülür.

